艾滋病是一种危害性极大的传染病,由感染艾滋病病毒(HIV病毒)引起。HIV能够把人体免疫系统中最重要的T淋巴细胞作为主要目标,大量该细胞,使人体免疫功能。因此,人体易于感染各种疾病,并可发生恶性肿瘤,病死率较高。攻克艾滋病一直是科学家们努力的方向和目标,今天生物谷小编就带大家浏览一下过去一段时间都有哪些突破性进展。

来自美国大学医学院的研究人员发现在HIV感染的初始阶用一种小物质中的淀粉样纤维能够抗艾滋病的发展。
男性中包含淀粉样纤维,这种蛋白沉淀物质能够帮助HIV病毒吸附在人类细胞上,从而增加HIV的效率。因此在这项最新研究中,研究人员发现一种叫做CLR01的小物质能够干扰中淀粉样纤维促进HIV感染的功能,除此之外,这种小物质还可以病毒本身。
来自杜克大学等处的研究者通过研究了为何艾滋病病毒疫苗试验联盟(HVTN)505临床试验中使用的候选疫苗不能够有效机体抵御HIV的感染,尽管其可以潜在机体产生抗HIV的抗体,这种特殊疫苗可以刺激抗体识别HIV及肠道中发现的微生物(部分是机体的微生物组)。
这项研究中,研究者检测了接受原始增强疫苗参与者的样本,结果发现,大部分疫苗的抗体都可以识别HIV的表面蛋白gp41,但这些抗体并不能够中和HIV,相反这些抗体具有多反应性并且可以识别常见细菌的蛋白,比如大肠杆菌等。研究者指出,这种多反应性仅可以促进靶向作用gp41的无效抗体的产生,而这些抗体并不会有效中和HIV。
来自大学戴维斯分校(UC Davis)的科学家通过研究鉴别出了一种特殊化合物可以激活潜在的HIV,从而就可以使得病毒从病毒库中“流出”,进而彻底治疗HIV感染,目前这种名为PEP005的化合物已经得到了FDA的批准。
研究者表示,这种名为PEP005的化合物是FDA批准的抗癌药物PICATO的活性成分,其可以增加患者血液中HIV的激活,同时表现出低毒性;除了PEP005外,研究者还发现了另外一种名为JQ1的,该可以同PEP005协同作用来使得HIV的激活最大化,当两者结合时可以增加HIV激活程度高达15倍。
目前PICATO的活性已经被批准用于病人的治疗中,由于其可以有效激活HIV,因此其可以同其它潜在的激活制剂一起作用来帮助患者抵御病毒的感染。
一个研究小组了HIV病毒是如何利用免疫系统自身"工具"逃避了机体免疫应答并成功入侵宿主的第一道免疫防线。
在这项研究中,研究人员发现当pDC遇到HIV感染细胞,感染细胞表面的BST2蛋白能够调节pDC细胞对干扰素的合成过程。研究人员发现BST2能够与pDC细胞表面的ILT7受体结合并将其激活,随后向下传递信号干扰素合成,阻滞pDC细胞发挥免疫防御功能。
这项研究了HIV病毒利用BST2与ILT7之间的调控过程机体抗病毒应答的重要机制,这一机制的发现对于了解HIV 病毒如何在体内并导致持续染具有重要意义。
来自美国Scripps研究所的研究人员发现天然化合物Cortistatin A 能够降低感染细胞内潜伏的病毒水平,建立一种近于永久性的病毒潜伏期,大大减弱病毒的重激活能力。
研究人员从接受不同抗逆病毒药物治疗的9名病人体内分离得到处于病毒潜伏期的原代T细胞,进行HIV病毒重激活检测,结果发现Cortistatin A能够大大降低病毒的重激活率。
这项研究表明以类似Cortistatin A的Tat剂对目前的HIV治疗方法进行补充,可以达到更高的治疗效果,显著降低病毒水平,防止潜伏病毒的重激活。
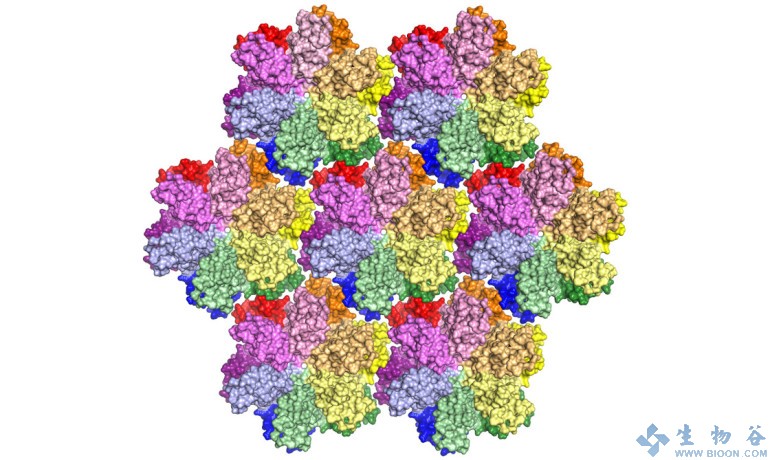
HIV病毒衣壳的稳定性微改变是感染成功的关键:太稳定的衣壳外壳,内部的“货物”就永远不会被正确传递;不够稳定的衣壳,其内容物会被身体的免疫防御检测,触发抗病毒反应。所以说衣壳的稳定性是攻克HIV一个关键。
来自密苏里大学医学院的研究人员创造了一个目前最完整的HIV衣壳蛋白的模型。研究小组使用了一种名为X射线晶体学技术(X-ray crystallography)来解开蛋白质的秘密。通过集合蛋白的多个副本图片,他们拼接成有模式的晶格。随后,他们在晶体上打出高功率X射线束。通过摸索分析X射线在打到蛋白时候发生何样的散射,研究人员制作出蛋白质的3D图。
来自贝丝-以色列-迪肯尼斯医疗中心的研究人员通过研究开发出了一种新型的HIV-1疫苗方案,其包含了一种由纯化的包膜蛋白增强的病毒载体,这种新型疫苗可以为一半已接种的类灵长类动物提供完全的作用,来帮助抵御猴免疫缺陷病毒(SIV)的六重。
此前研究发现,基于腺病毒载体的HIV-1候选疫苗可以针对SIV提供部分作用,而本文中研究者进行了两项最新研究,他们评估了由纯化的包膜蛋白增强的26型腺病毒(Ad26)载体疫苗给机体提供的效力。
研究者希望尽快将这种新型疫苗投入到人类临床试验中,从而为HIV疫苗的研究提供更多的研究数据和创新性。
Science发表了一篇评论文章,分析了如何通过分析HIV病毒的家族进化树来研究病毒的扩散。了解到这样信息,我们可以追踪病毒的扩散方式,进而制定精准的干扰治疗策略来针对HIV病毒。
这个方法的核心假设是,如果两个人携带的HIV病毒的核酸序列差异小于1.5%,那么很可能这两个人来自于同一个“传染群体”(transmission cluster),他们HIV感染事件是密切相关的。已经有几个课题组进行了类似的研究。通常认为,HIV病毒在传代过程中的突变率是恒定的,研究者可以据此构建一个生物钟来估算携带者是何时感染病毒的。再结合在同一个地理区域内的HIV携带者那得到的信息,研究者能够构建类似航线图那样的图像来估测HIV病毒的方向和速率。
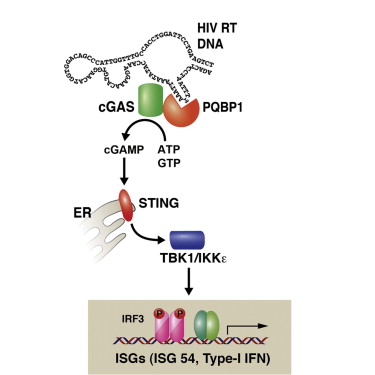
来自美国Sanford-Burnham医学研究所的Sumit K. Chanda课题组在《Cell》发表了他们关于HIV-1相关的PAMP与cGAMP是否存在直接的相互作用这一问题的最新研究。
首先,作者通过体外的HIV-1模拟感染(加入SIV-Vpx蛋白进行辅助)发现BMDC能够产生显著的IFN的表达。
之后,作者利用RNAi筛选的方式找到了识别HIV-1 DNA从而介导IFN表达的中间信号。作者发现病毒感染后能够引起明显的PQBP1与HIV-1核酸的相互作用,进一步的Dnase/Rnase处理显示与PQBP1相互作用的核酸物质是DNA而非RNA。
最后,作者发现将BMDC中cGAS进行敲低能够影响HIV-1引起的IFN信号,由于之前研究cGAS是重要的DNA免疫反应元件,这一结果说明cGAS可能参与了PQBP1介导的抗HIV-1天然免疫反应。
据《自然》(Nature)在4月8日刊登的一封信透露,利用强大的抗体在人类免疫缺陷病毒(HIV,又称艾滋病毒)患者身上测试一种疗法的首次研究将HIV病毒载量最多减少至原来的三百分之一。
这种抗体被命名为3BNC117,是一种“广泛中和”的人类抗体,大约10%至30%的艾滋病毒感染者在被感染几年之后都会产生这种抗体,但到那时,艾滋病毒几乎总是已经演变得得让这种抗体鞭长莫及。但在他们产生这种抗体之前向他们的身体注入这种抗体,就让他们获得一个优势。这种抗体专门针对艾滋病毒外壳与细胞结合的基本位点——叫做CD4结合位点。这个位点意味着艾滋病毒与细胞结合然后在细胞内复制。
接下来的步骤包括进行规模更大、时间更长的研究,涉及更加多样化的艾滋病毒感染者,并且探索如何改进免疫疗法的办法。









最新评论