重组酶聚合酶扩增(Recombinase Polymerase Amplification,RPA),被称为是可以替代PCR的核酸检测技术。本专题为大家详细介绍RPA的原理、引物设计、疑难解答以及在致病菌检测、病毒检测以及癌症研究中的灵活应用。
自PCR技术诞生以来已经有三十年了,从经典PCR、实时定量PCR再到现在的数字PCR,这一技术在不断却从未淡出我们的视野。很多人的实验根本离不开PCR。笔者曾经也接触PCR很长一段时间,加样、设置程序、等待、检测。这些过程看起来容易,但实验结果却总是会出人意料,很多时候根本不知道是哪里出了错。那么要是有一款技术,它比PCR更快速、便捷、高效,你会感兴趣吗?
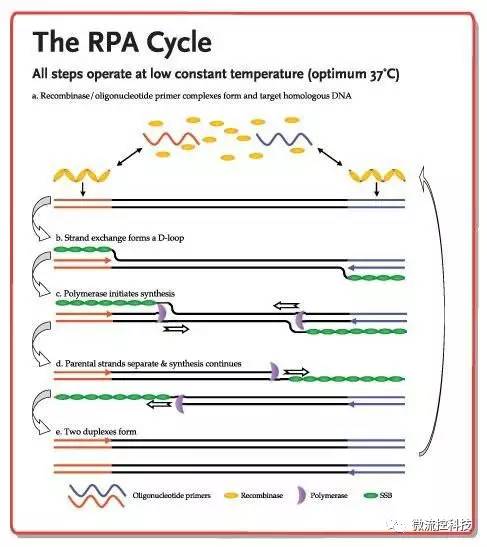
重组酶聚合酶扩增(Recombinase Polymerase Amplification,RPA),被称为是可以替代PCR的核酸检测技术。RPA技术主要依赖于三种酶:能结合单链核酸(寡核苷酸引物)的重组酶、单链DNA结合蛋白(SSB)和链置换DNA聚合酶。这三种酶的混合物在常温下也有活性,最佳反应温度在37°C左右。
重组酶与引物结合形成的蛋白-DNA复合物,能在双链DNA中寻找同源序列。一旦引物定位了同源序列,就会发生链交换反应形成并启动DNA合成,对模板上的目标区域进行指数式扩增。被替换的DNA链与SSB结合,防止进一步替换。在这个体系中,由两个相对的引物起始一个合成事件。整个过程进行得非常快,一般可在十分钟之内获得可检出水平的扩增产物。
RPA分析的关键在于扩增引物和探针的设计。PCR引物多半是不适用的,因为RPA引物比一般PCR引物长,通常需要达到30-38个碱基。引物过短会降低重组率,影响扩增速度和检测灵敏度。在设计RPA引物时,变性温度不再是影响扩增引物的关键因素。RPA的引物和探针设计不像传统PCR那样成熟,用户需要自己摸条件进行优化。
常规PCR必须经过变性、退火、延伸三个步骤,而PCR仪本质上就是一个控制温度升降的设备。RPA反应的最适温度在37℃-42℃之间,无需变性,在常温下即可进行。这无疑能大大加快PCR的速度。此外,由于不需要温控设备,RPA可以真正实现便携式的快速核酸检测。
据介绍,RPA检测的灵敏度很高,能够将痕量的核酸(尤其是DNA)模板扩增到可以检出的水平,从单个模板得到大约1012扩增产物。而且RPA还用不着复杂的样品处理,适用于无法提取核酸的实地检测。
RPA既可以扩增DNA也可以扩增RNA,还省去了额外的cDNA合成步骤。你不仅可以对扩增产物进行终点检测,还可以对扩增过程进行实时,甚至可以通过试纸条(侧流层析试纸条LFD)读取结果。
RPA对硬件设备的要求很低,特别适合用于体外诊断、兽医、食品安全、生物安全、农业等领域。以下为大家介绍RPA在细菌、病毒检测以及癌症研究等领域的应用情况。
在今年发表的一系列文章中,RPA技术被广泛用于梭状芽孢杆菌、结核杆菌、耐甲氧西林金葡萄球菌MRSA、淋病奈瑟氏菌(Neisseria gonorrhoeae)、沙门氏菌、大肠埃希菌STEC等常见致病菌的检测。在临床诊断和食品安全方面,为人们提供了简单快速的实地筛查方案。(这篇文献之前网站报道过,在这里就不详述了。)
沙眼衣原体(Chlamydia trachomatis)感染是最常见的性疾病之一。沙眼衣原体影响5-10%的人口,常见于小于25岁的成年人。目前广泛使用的沙眼衣原体检测方法是以聚合酶链反应(PCR)技术为基础,这种方法只适合于经过专业训练的人员在具有特定仪器的实验室使用。
日前,发表在《诊断》(The Journal of Molecular Diagnostics)上的一项研究中,研究人员利用RPA技术开发了一种检测沙眼衣原体的快速、灵敏的新方法,利用该方法在20分钟内即可得出检测结果。
研究人员利用RPA技术直接从患者尿液样本中检测沙眼衣原体,不需要从尿液样品提取总DNA,也不需要专门的仪器设备。而且该检测方法还具有少费力、少耗时、更经济等特点。与目前的沙眼衣原体检测方法比较而言,该方法还能够显著提高检测的性和性
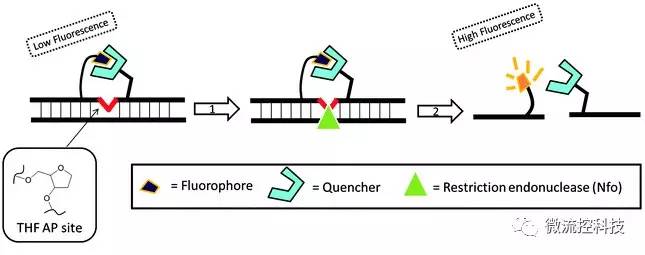
核酸扩增是目前最灵敏的疟原虫(P. falciparum)性检测法。然而,PCR需要热循环设备和专业性操作,资源匮乏的地区往往难以满足这些条件。在这种情况下,与侧流层析结合的RPA有着很大的应用前景。
《Malaria Journal》今年三月份发表的一项研究中,研究人员将RPA基础反应、TwistAmp nfo探针和侧流层析结合起来,实现了疟原虫18S rRNA基因的高灵敏度快速检测。在38°C的条件下,只需要不到十分钟的扩增,就能检出含有四个疟原虫的样本。加上侧流层析的检测时间,整个流程总共只需要15分钟,而且可以直接看到检测结果。
研究人员用不同疟原虫测试了这种方法的灵敏度和性。研究显示,所有疟原虫都被成功检出,所有非疟原虫都得出了阴性结果。文章指出,这一方案将大大改善资源匮乏地区的疟原虫诊断。
目前,MERS-CoV检测主要依赖于实时RT-PCR,需要收集患者样本然后到专门的实验室去检验。因此,亟需能够进行实地检测的快速装置。
《PLOS Currents:Outbreaks》去年十二月发表的一项研究,开发了一个能在3-7分钟内鉴定MERS-CoV的便携式RT-RPA装置。在42°C条件下,等温MERS-CoV RT-RPA与实时RT-PCR一样,可检出10个RNA。文章指出,这个便携装置是MERS-CoV,寻找其动物宿主的理想方法。
检测传染性疾病的综合panel,有助于资源匮乏地区进行实地诊断,对生物防御工作也有很大的帮助。
在HIV诊治中,即时检测常重要的,对婴儿来说更是如此。有案例显示,HIV感染后立刻进行治疗就能控制住患者体内的病毒,让它们无法进行复制。举例来说,生来就携带HIV的密西西比婴儿,在出生后立即得到了治疗。后来这个孩子停药了两年多,病毒复制依然得到了控制。
目前婴儿HIV诊断的金标方法是DNA PCR,但许多地区并不具备这样的条件。在这种条件下,RPA技术正好可以大展身手。(四篇论文介绍了RPA在HIV检测中的应用)
去年六月,新加坡A*STAR的研究团队在Lab on a Chip上,发表了一种能够快速检测癌症单点突变的新技术,等温固相扩增/检测(ISAD)。这是一种无需标记的实时检测技术,将基于硅基微环(silicon microring)的固相扩增与等温重组酶聚合酶扩增(RPA)结合在一起。
去年十月,Talanta上也发表了一项用到RPA技术的癌症研究。该研究在超灵敏生物条码分析(BBC)、适配体(aptamer)和RPA的基础上,开发了一个检测细胞色素C(Cyto-c)的新生物条码分析法(ABC)。细胞色素C是细胞死亡的重要标志物。(点击链接查看这两项研究的详细报道和文献)

说了这么多,你们肯定会有很多疑问,引物怎么设计?RPA反应能实现多重化么?RPA反应能对模板进行定量么? RPA支持生物素或荧光标记的寡核苷酸么? RPA支持生物素或荧光标记的寡核苷酸么?以下就为大家一一解答。
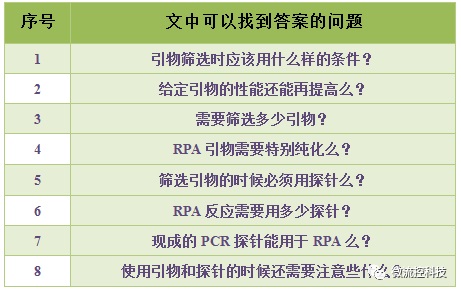
RPA的扩增引物可以说是整个反应的关键所在,那么怎样才能设计好RPA引物呢?引物长度怎样选择?引物序列有什么要求?扩增产物长度有何?筛选的主要流程?答案详见《RPA:引物与探针的常见问题》一文。此外,在该文中你还可以找到以下问题的答案。
可以。RPA技术支持在同一个管中同时进行多个扩增反应。不过,多重化的引物组合需要精心设计,以便每个引物都能同样有效的工作。需要注意的是,RPA反应的引物总量(nmol)最好不要超标太多。如果在一个反应中使用两个以上的扩增引物,就应该控制不同引物的量。另外,我们应当事先考虑好检测多个扩增事件的探针、设备以及荧光团的兼容性。
可以。扩增子达到可检出水平的时间,依赖于反应起始时的模板量。初始模板的拷贝越多,扩增子就越快达到可检出水平。不过,这种定量需要精心的实验安排,确保对照反应是同时开始的。举例来说,可以利用镁离子的添加时间进行控制。因为镁离子一旦进入体系,RPA反应就会开始。
此外,较慢的扩增过程有助于更精确的定量。我们可以通过调整反应条件或引物设计来减慢RPA的反应速度。
支持。在RPA反应中,连有生物素或荧光团的引物与未修饰的引物表现差不多。据悉还没有发现任何差异。
可以。插入性染料可以在RPA反应中进行定量和。不过,这种染料可以结合任何双链DNA,会生成来自引物的假阳性信号。由于RPA扩增在常温下进行,这种噪音会比PCR严重一些。
小编其实对PCR还是蛮有阴影的,之前很多做生物学的朋友经常说的一句就是:“怎么又没P出来!”PCR好像“承包”了核酸检测似的。虽然小编现在不用做实验室了,但是还是希望新技术可以对在科研一线的你们有帮助。
特别鸣谢:本专题资料主要来源生物通(叶予),另有少部分资料(RPA技术建立沙眼衣原体快速检测方法)来自细菌学专业网。









最新评论