据报道CAR-T领跑企业Kite Pharma公司的CAR-T项目axicabtagene ciloleucel(KTE-C19)在4月底出现了1例患者死亡事件。Kite Pharma刚刚在3月31日宣布完成提交axicabtageneciloleucel的BLA,也是目前仅存的两家最有希望优先上市的企业。然而近日公开的死亡案例还是引起了公司股价开盘大跳水,盘中最大跌幅一度达到15.9%,最低跌至68.75美元。
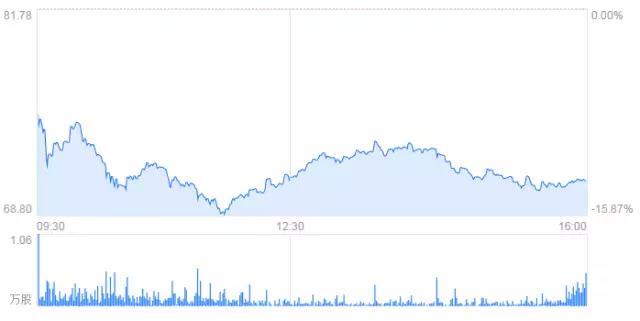

Kite制药首席医学官David Chang表示:“这例死亡患者是安全性扩展研究(n=30)招募的一例难治性非霍奇金淋巴瘤患者,入组时就已经处于疾病爆发期,疾病进展很快。治疗后产生了神经毒性事件,并迅速恶化,出现多器官衰竭和致命性脑水肿,2天后不治身亡。”
Kite制药公司在回应Endpoints记者John Carroll的邮件中表示:“我们并不认为这例患者死亡代表KTE-C19存在重大安全性问题。KTE-C19的开发研究会继续按计划进行。需要提醒大家的是,KTE-C19治疗相关的5级严重不良反应在200例接受过治疗的患者中的发生率只有2%。如果再加上NCI资助的研究所治疗的患者,已经有超过300例患者接受了CTE-C19的治疗”。
虽然死亡率很低,FDA也没有因此暂停这项临床研究。Kite公司也一再强调它已经完成了向美国FDA提交axicabtagene ciloleucel(CD19-CAR-T)治疗晚期NHL患者的BLA申请。但是这一事件还是引起行业内人士的关切。
同样采用CD28作为共刺激结构域的CAR-T公司Juno的JCAR015事件,这仅仅是巧合吗?
CAR-T疗法JCAR015 代号为ROCKET(火箭)的II期研究主要考察对复发或难治性B细胞急性淋巴细胞白血病(r/r ALL)患者的疗效和安全性,出现了第1例脑水肿死亡病例,FDA当时并未要求Juno调整试验方案。
ROCKET研究又连续出现2例脑水肿死亡病例,因此被FDA紧急叫停。当时Juno将原因归咎于化疗药物氟达拉滨,向FDA提出只使用环磷酰胺进行预处理并继续进行JCAR015研究。7月12日,FDA宣布Juno在排除预处理化疗药物氟达拉滨的使用后可以继续进行JCAR015的II期临床试验。
Juno宣布主动暂停CAR-T疗法 JCAR015的II期研究,因为研究中再出现2例脑水肿患者,其中1例已经死亡,另外1例患者根据11月22日夜间的形势来看也是希望渺茫。2017年3,Juno正式宣布放弃开发JCAR015项目。
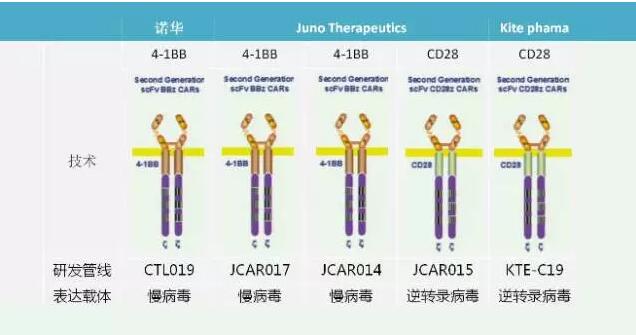
众所周知,目前业内采用CD28做共刺激结构域的CAR-T技术公司主要有Juno和Kite。各家CAR-T公司在最开始上CAR-T疗法的临床试验所使用的技术主要包括CD28和4-1BB两种共刺激结构域。其实早在2014年,就有相关研究比较了CD28与4-1BB结构域的差异。
CD28作为共刺激结构域的特点是刺激CAR-T细胞在体内迅速扩增,但同时也使得细胞迅速耗竭,因此预测可能复发率较高;4-1BB作为共刺激结构域,刺激的CAR-T细胞在患者体内扩增相对CD28激活的CAR-T细胞较温和,但存续时间更长,预测可能复发率更低。而另一家领先CAR-T研究企业诺华则是很早就使用了4-1BB做共刺激结构域。
Juno在其CD19靶点CAR-T产品中,除了JCAR015以外,JCAR014和JCAR017均采用4-1BB作为共刺激结构域,即4-1BBzCAR。而Juno此前力推CD28zCARJCAR015急性淋巴白血病治疗,可能更多是从商业竞争角度考虑的无奈之举,即为了在同诺华和Kite的竞争中抢得先机,成为首个获得FDA批准的CAR-T商业化疗法。在历经5例病人意外死亡、临床试验叫停后,Juno最终选择放弃JCAR015, 转而重点发展JCAR017,显示其向4-1BBzCAR的全面转型。

2017年3月,诺华官网发布消息称,FDA批准其公司CAR-T细胞治疗候选药物CTL019的生物药品许可申请(BLA)进入优先审查。这次批准的CTL019(商品名:tisagenlecleucel-T)适用于儿童和年轻复发难治型B淋巴细胞白血病(B-ALL)。
诺华公司(Novartis)此次获批优先审核是基于一组CTL019的II期试验,在输注CTL019后有82%的人(n=41/50)三个月达到完全缓解,或不完全血细胞计数恢复的完全缓解。早在去年的第57届美国血液病学会(ASH)年会上,诺华公布了CAR-T免疫疗法CTL019的II期临床研究的一组惊人数据。数据显示,接受CTL019治疗的患者在复发性/难治性急性淋巴细胞白血病(r/r ALL)儿童及年轻患者中完全缓解率达到了93%(n=55/59)。
2017年4月,FDA授予诺华CTL019第二项突破性疗法资格,用于治疗复发及难治性(r/r)弥漫性大B细胞淋巴瘤(DLBCL)成年患者,适用于以前对两种或更多种疗法失败的患者。
诺华CTL019的成功也说明对于技术含量极高的CAR-T治疗领域,对技术线的判断和选择至关重要。而未来这一领域的技术发展速度也很可能大大超出多数的预期,是否拥有一流的研发能力显得尤为重要。对技术线的判断选择和一流的研发能力将成为决定CAR-T公司发展成败的关键性因素。

众所周知,一个临床新药的疗效和安全性必须在临床实验中得到验证才能通过监管部门的审批上市,这些临床实验通常是有足够受试者参与的随机、双盲、和对照实验。比如Kite公司是以CAR-T疗法为主要资产的生物制药公司,任何和临床实验相关的都会严重影响其股市表现,更重要的是提前披露不成熟的实验结果也会影响临床实验的严谨性。
虽然该KTE-C19实验是一个单臂、标签的多中心实验,但患者在治疗过程中死亡是临床实验的一件大事,无论对患者、公司还是投资者都是一个不幸。虽然受试者在入组时已经处于疾病爆发期,再加上CAR-T疗法最常见的“细胞因子风暴”又非常强烈,所以CAR-T细胞疗法发亡并不意外。
但脑水肿死亡机理未知就如同躲在暗处的杀手,令人更加。肿瘤治疗作为一块难啃的骨头,更是无数科研者们的心头大患。CAR-T疗法在血液性肿瘤治疗上的显著疗效我们不可否认,这无疑是个性的技术进步。
然而,尽管疗效喜人,但安全性问题却一直让临床研究如履薄冰。此次的CAR-T治疗NHL患者引起的死亡事件再次敲响了警钟,当然对于NHL患者还有其它治疗方法。包括可控性和安全性比较高的双抗体治疗,对NHL的应答率为70%。
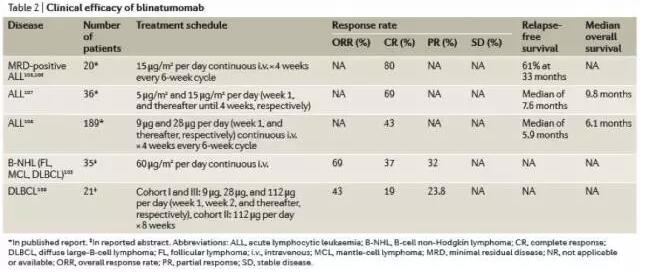
另外PD-1抗体虽然安全性更好、也已被批准用于cHL,但对NHL的应答率并不高。所以目前针对NHL患者的治疗方法还是CAR-T比较领先,当然安全性有待改善。
尽管CAR-T遇到了诸多阻碍,但这不足为奇,该领域的前景依然是乐观的。在临床试验中患者的死亡当然是我们最不想看到的事情,但是通常,我们从其中学到的东西实际上可以让我们向前迈进。此次意外事件再次提醒相关企业在临床研究中要更加重视病人安全和意外事件的发生,甚至有可能加速促进行业优势资源的集中,当然我们也希望此次事件是偶然事件,毕竟CAR-T细胞治疗技术仍将是当下最具希望的肿瘤精准疗法,我们对癌症免疫治疗仍持乐观态度。









最新评论