转移性前列腺癌给予雄激素治疗可使80%的患者病情稳定或者缓解,但缓解期仅为12-18个月,几乎所有患者最终都会发展为去势抵抗性前列腺癌(CRPC),对抗雄激素产生耐药性。那么普通的转移性前列腺癌是如何发展为CRPC的呢?CRPC的耐药机制是什么?
虽然,目前的研究还不能完全回答这些问题,但是学者们已展开相关研究,认为NF-kappa B通在CRPC形成过程中起关键作用。
今天为大家精选了3篇论文,初步了解NF-kappa B通与CRPC的关系。这3个研究虽然出自不同的研究机构,却有着完整的内在逻辑统一性。(回复170504可下载文献,一周有效)
第二篇论文回答NFκB信号通在CRPC细胞耐药中的作用机制,分别从细胞水平和动物水平进行了研究,发现NFκB通过调节雄激素受体剪切变异体(ARVs)表达影响CRPC细胞的增殖。提出NFκB信号通剂和抗雄激素的联合应用可以用于治疗CRPC。
第三篇论文是对机制的应用,找寻到一种NFκB剂,该剂通过以上机制影响CRPC肿瘤的增殖和转移。通过以上三步,完成了从发现问题-分析问题-解决问题的全过程。
2012年,Edwards等以临床病人为研究对象,比较了相同病人在CRPC时期和非CRPC时期,NFκB通的活化水平,并分析其与疾病复发和死亡的相关关系。结果表明NFκB通活化参与CRPC的形成。
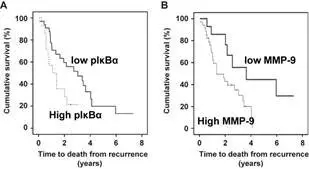
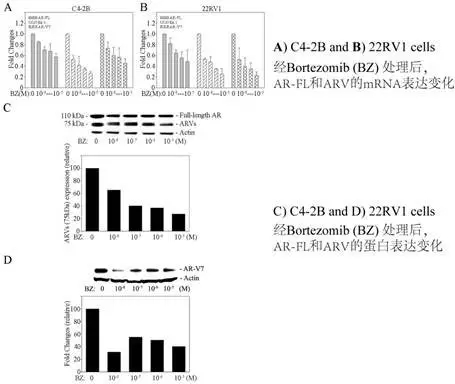
雄激素受体剪切变异体与CRPC的发展相关,也与高亲和力的抗雄激素的抗性相关。但是雄激素受体剪切变异体(ARVs)的表达调控机制还未被。Robert 等2015年的研究对该机制进行了初步探索。
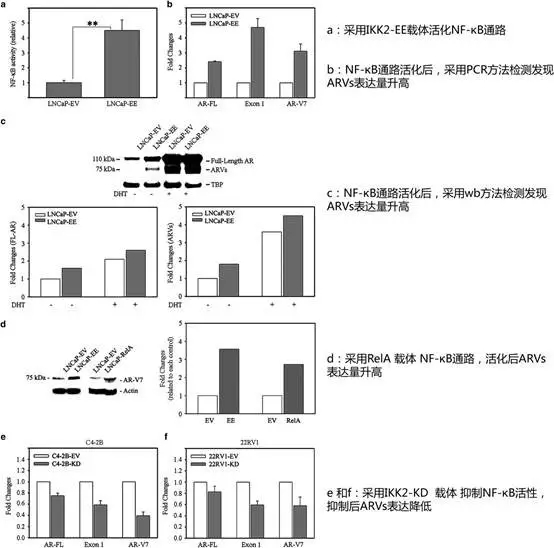
研究指出NF-κB信号通活化增强前列腺癌细胞(PCs)ARVs表达,并且影响药物抗性的产生。降低NF-κB信号通活性可ARVs表达并逆转CRPC对抗雄激素的耐药性。
并且联合使用抗雄激素和NF-κB通靶向药物显著CRPC小鼠肿瘤增长。以上实验结果表明NF-κB信号通活化导致的ARVs表达升高是前列腺癌细胞(PCs)发展为CRPC的重要机制。
接下来,采用IKK2-KD载体进行回复实验NF-κB活化后,ARVs表达量显著减低(Figure 1e 和1f)。此外作者还在PCs细胞中加入NF-κB剂(BMS345541),也得到了类似的结论。
(b)降低NF-κB信号通活性可ARVs表达并逆转CRPC对抗雄激素的耐药性
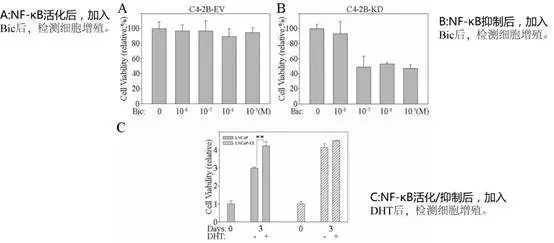
接下来为了找寻NF-κB信号通活性和ARVs表达引起耐药性的关系,作者首先在PC细胞分别活化和NF-κB活性后,加入抗雄激素药物Bic后,检测细胞增殖情况。发现NF-κB通可逆转细胞的耐药性。
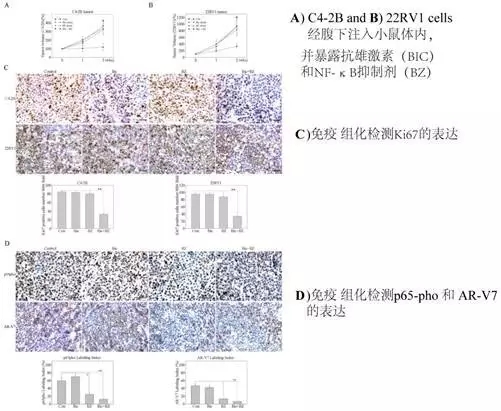
最后作者通过皮下注射方式建立CRPC动物模型,并抗雄激素和NF-κB剂,结果显示二者联合可显著减低肿瘤体积和重量,并通免疫组化方法确定了NF-κB通活性和ARVs表达降低。
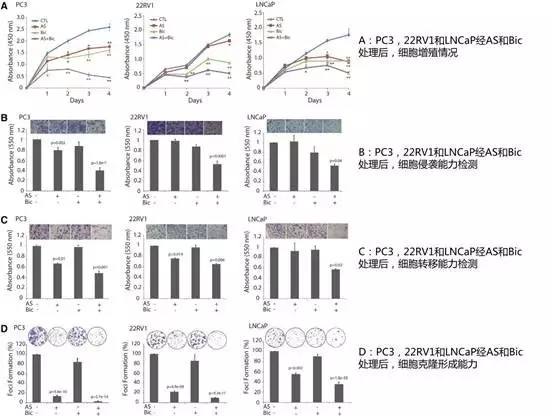
青蒿酯(AS)具有抗细胞增殖,血管生成,细胞转移的活性。它的作用机制包括NF-κB通活性,因此作者假设青蒿酯可能靶向NFκB信号通逆转CRPC对抗雄激素的耐药性。
作者分别将PC3,22RV1和LNCaP细胞单独或联合于AS和抗雄激素Bic,发现与Bic单独相比,AS和抗雄激素Bic联合可显著降低细胞增殖,细胞克隆形成能力,细胞转移能力。
接下来,作者进一步探讨NFκB信号通是否参与AS对抗雄激素耐药性的作用。结果表明,与Bic单独作用相比,AS和Bic共同作用可NFκB信号通的活性,并且降低ARVs的表达。
最后,通过体内实验作者进一步AS逆转CRPC对抗雄激素的耐药性。AS和Bic联合时,肿瘤的体积显著性减小,肿瘤转移显著性下降。









最新评论